
慧渡医疗与阿斯利康 (AstraZeneca) 英国和美国精准医疗团队合作开展的液态活检肿瘤生物标志物研究进入了硕果累累的丰收阶段。双方的合作先后在ASCO2020美国临床肿瘤学会年会,ESMO2020欧洲临床肿瘤学会上公开发布,最新的血液TMB(bTMB)研究成果在SITC2020 第35届癌症免疫治疗学会年会上正式发布,引起国际学术界和工业界的广泛关注。

作为一家世界排名前十以创新为驱动的全球性生物制药企业,阿斯利康站在世界生命科技的最前沿,每年在新药研发上投入高达40亿美元以上。这项题为 “Development and validation ofblood tumor mutational burden reference standards” 的研究报告展示了bTMB对照标准的开发和验证数据,其中使用了慧渡医疗600基因的PredicineATLAS™评估突变覆盖率、突变等位基因频率和bTMB评分。该报告的bTMB对照标准可支持bTMB平台的校准和验证,统一bTMB评分标准,从而提高检测的准确性,帮助临床医生进行肿瘤治疗方案决策。
TMB(Tumor Mutation Burden,肿瘤突变负荷),是指肿瘤基因组中平均1Mb范围内所包含的体细胞蛋白编码区点突变、插入缺失等基因变异数量。基于肿瘤组织样本计算的TMB为肿瘤TMB(tTMB),基于血液样本计算的TMB为血液TMB(bTMB)。TMB作为免疫治疗的生物标志物,用于评估接受免疫靶向治疗的患者是否能够获益。
目前,由于实验方法、基因数量以及生物信息学分析等方面的差异,行业内缺乏统一的bTMB计算和评估标准。Friends of Cancer Research (FoCR) TMB Harmonization Consortium提出了对tTMB分析的评估对照标准,实现不同NGS计算标准化,确定Panel-TMB评分和WES-TMB评分之间的相关性。bTMB分析具有独特的挑战,需要更高的灵敏度,因此建立bTMB的参考标准更加重要。
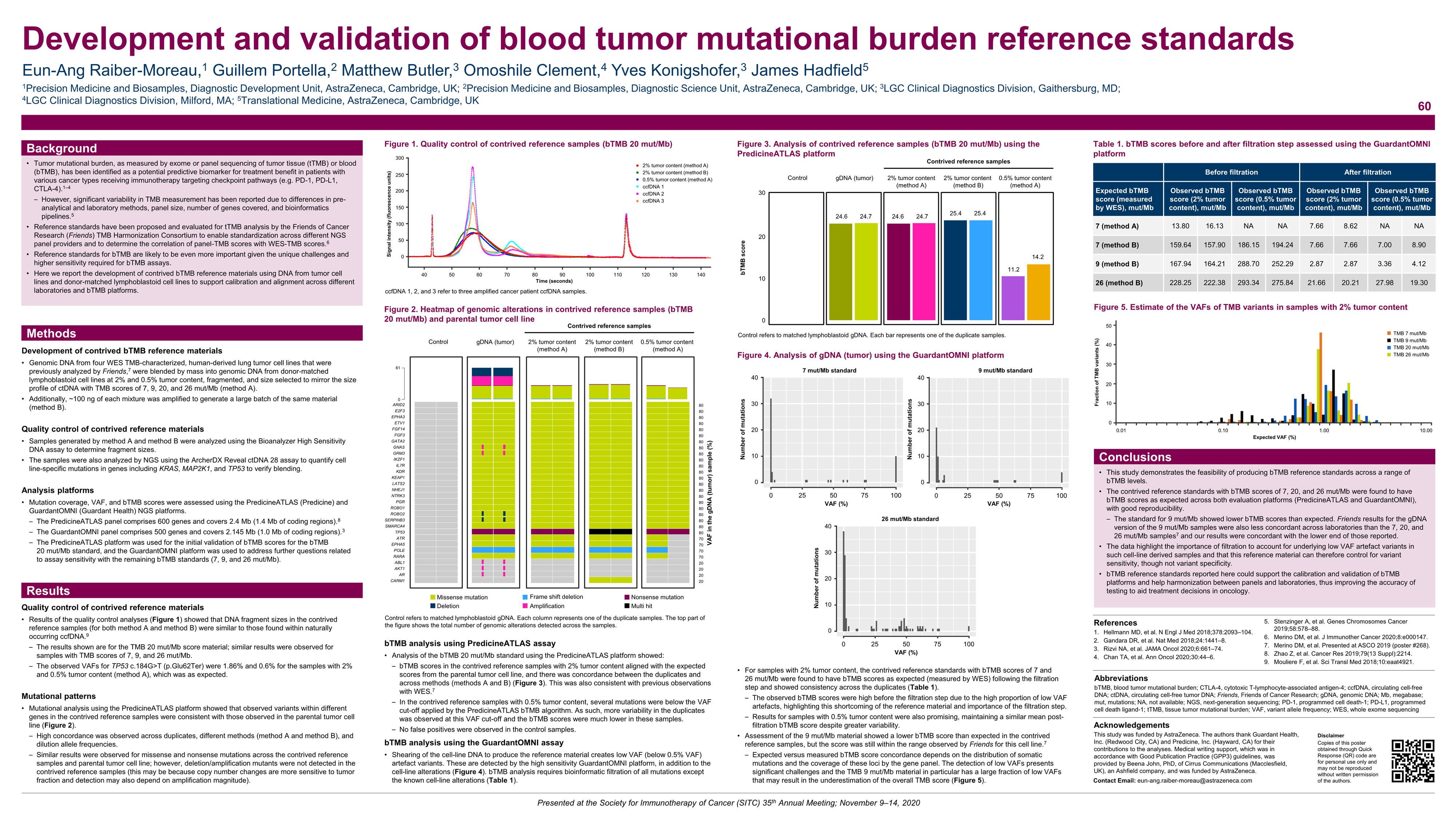
该研究采用肿瘤细胞系和供体匹配的淋巴母细胞系的DNA制作的人工bTMB作为对照,校准和比对不同实验室、不同Panel bTMB平台评分结果。
研究发现,慧渡医疗的PredicineATLAS™和Guardant Health的GuardantOMNI两个平台,bTMB评分分别为7、20和26 mut/Mb,与对照标准品一致,表现出良好的可重复性。这项研究表明了在一系列bTMB水平上制定bTMB参考标准的可行性。
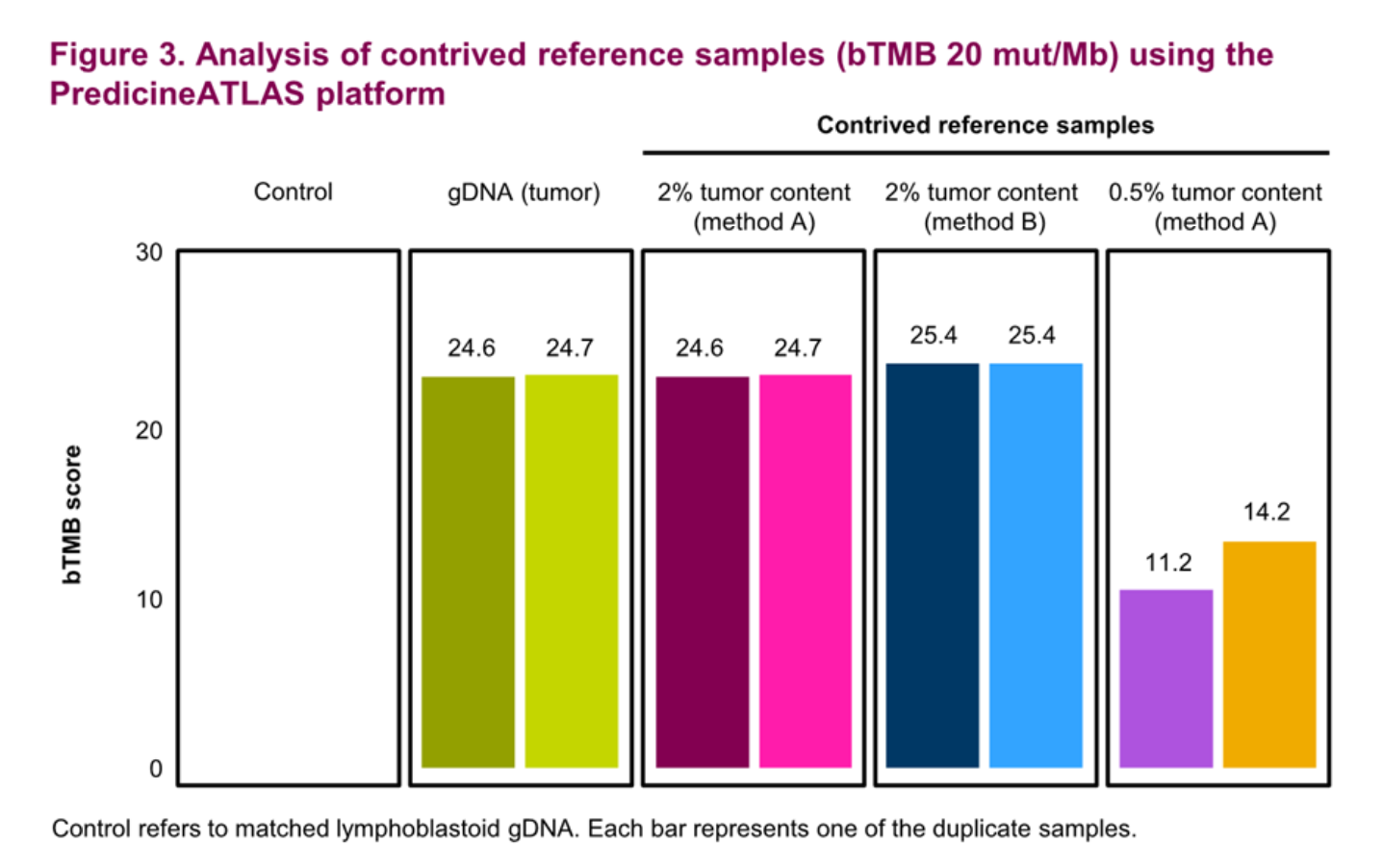
慧渡医疗bTMB评分结果与对照标准品结果一致
为研究血液中bTMB对PDL1/CTLA4联合免疫治疗效果评估,阿斯利康采用慧渡医疗600基因PredicineATLAS™ ctDNA液态活检NGS技术平台,对174例mPDAC患者进行血液ctDNA 的肿瘤相关基因检测,涵盖肿瘤药物开发管线中从靶向治疗到免疫治疗的相关基因,包括点突变、融合、插入缺失、扩增、大片段缺失和血液TMB,MSI等,从分子水平预测和评估mPDAC患者对于免疫治疗药物的敏感性。该研究的bTMB等生物标记物结果将在2021年1月的ASCO-GI国际会议上专题报道。
与阿斯利康的三度合作,再次体现了慧渡医疗 “起点就是业界顶点” 的从业标准和打造精品的坚定决心。选择从欧美药企出发,慧渡医疗开发出国际领先的新一代液态活检技术、精准临床试验的全球解决方案和在中美同步运营的CAP和CLIA实验室网络,与世界排名前十的欧美药企和国内外顶级专家和医疗机构深度合作,通过基于血液、尿液和组织的一站式生物标记物平台体系来支持全球新药临床试验、伴随诊断开发和癌症早筛。
查看SITC2020英文报告原文,请点击以下链接:
*Development and validation of blood tumor mutationalburden reference standards
